Одной из технологий медицины будущего являются аптамеры — короткие молекулы ДНК или РНК, которые имеют много различных применений, включая функции антител, борющихся с патогенами. Однако существуют сложности в получении аптамеров для определенных задач — затруднительно предсказать, какой формой должна обладать молекула, чтобы связаться с нужной мишенью. Российские ученые и их зарубежные коллеги разработали новую методику моделирования модифицированных аптамеров с длиной, меньшей, чем у их предшественников. «Лента.ру» подробно рассказывает об исследовании, опубликованном в престижном научном журнале Molecular Therapy.
Мир нуклеинов
Нуклеиновые кислоты, к которым относятся ДНК и РНК, играют одну из главных ролей в функционировании любого живого существа. Они хранят в себе информацию о развитии организма, его физиологии и эволюции. Они не только кодируют в себе информацию о белках, но и выполняют множество важных функций, включая регуляцию генов. Например, короткие одноцепочечные РНК легко формируют сложные комплексы, в том числе рибозимы. Рибозимы — особые молекулы РНК, способные оказывать ферментативное действие, подобное белкам. Поэтому считается, что именно рибозимы могли существовать задолго до возникновения первой живой клетки, катализировать свое собственное размножение и мутировать в процессе химической эволюции, способствовав появлению жизни на Земле.
Благодаря прогрессу в области молекулярной биологии и бионанотехнологии одноцепочечные ДНК (оцДНК) стали полезным инструментом для медицины. Длинные оцДНК используются для конструирования ДНК-оригами — молекул почти любой формы, что подходит для создания новых наноматериалов, вычислительных устройств и даже ДНК-компьютеров. Короткие нуклеиновые кислоты, также называемые олигонуклеотидами, способны имитировать антитела — белки крови, распознающие и нейтрализующие патогены, включая вирусы и раковые клетки. ДНК-аналоги антител относятся к аптамерам, то есть молекулам, способным специфически связываться с молекулами-мишенями.
Аптамер впервые был получен в декабре 2004 года, это был пегаптаниб натрия, разработанный компаниями Pfizer и Eyetech. За 20 лет аптамеры стали широко использоваться в медицине для таргетной терапии — методе борьбы с раком, когда препараты блокируют рост и распространение опухолевых клеток через воздействие на специфические молекулы, которые необходимы для развития новообразования. Специфичность аптамеров делает их безопасными для здоровых тканей, которые не выделяют таких соединений.
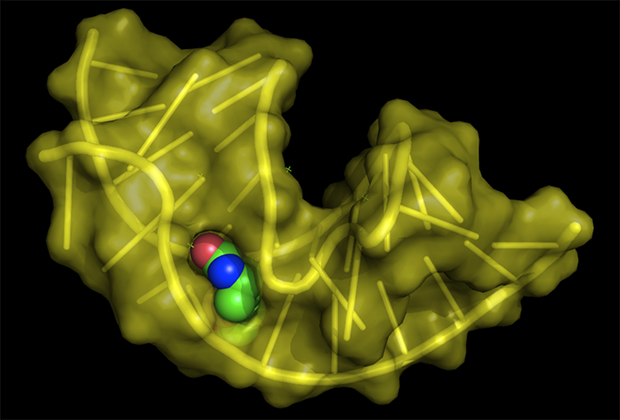
Структура РНК-аптамера, специфичного к биотину
Изображение: Fdardel / Wikipedia
В настоящий момент аптамеры получают с помощью искусственной эволюции. Метод SELEX заключается в создании большой коллекции олигонуклеотидов, состоящих из случайных последовательностей. Олигонуклеотиды взаимодействуют с веществом-мишенью, после чего удаляют те из них, что не смогли связаться с ним. Этот цикл повторяется несколько раз, и ученые отбирают те молекулы, что обладают наибольшим сродством к нужному соединению. Различия в свойствах оцДНК определяются их способностью складываться в сложные трехмерные формы. Молекулярная структура, в свою очередь, зависит от множества факторов, включая температуру, кислотность и наличие растворенных ионов.
ДНК-конструктор
Ученые МГУ и Красноярского научного центра совместно с коллегами из Финляндии, Германии, Канады, Японии и США решили сложную задачу оптимизации молекулы-аптамера для диагностики раковых клеток. В отличие от предшествующего ему соединения, у новой последовательности на 45 нуклеотидов меньше. Такое усечение сделало функции аптамера оптимальными и позволило улучшить связывание молекулы с клетками опухоли за счет его большей специфичности к специфическим белкам-мишеням.
создание первого аптамера — пегаптаниба, который блокирует фактор роста эндотелия сосудов и разрешен для использования в лечении влажной макулодистрофии сетчатки
Сконструировать аптамер с заданной молекулярной структурой — сложная задача, которая требует мощных компьютеров. Моделирование в масштабах атома может сгенерировать правдоподобные молекулярные структуры, однако выявление наиболее вероятных из них требует огромных вычислительных ресурсов. Это объясняется крошечной разницей в энергии между молекулами одинакового химического состава, но с разными молекулярными структурами.
Известно, что аптамер LC-18 может связываться с опухолевыми клетками аденокарциномы легких, тканями и плазмой крови с высокой специфичностью. LC-18 представляет собой последовательность из 80 нуклеотидов, включая два особых участка размером 20 нуклеотидов с каждой стороны — праймера. Праймеры выполняют вспомогательные функции, служа в качестве затравки для синтеза нового олигонуклеотида.
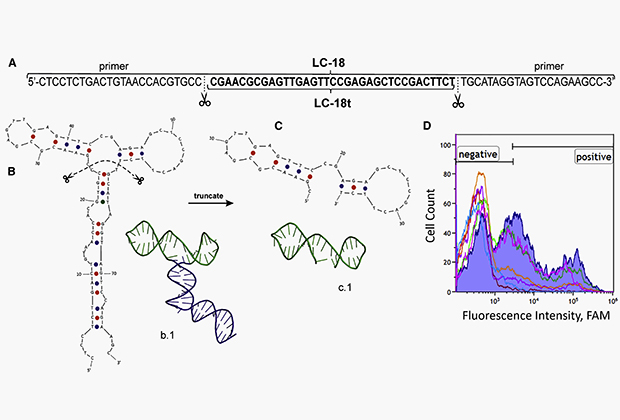
Структура аптамера LC-18t и его предшественника
Изображение: Elsevier Inc.
Существует необходимость в уменьшении размера аптамеров для улучшения связывающих свойств и удешевления синтеза. Исследователи добились синтеза сильно усеченного LC-18 (LC-18t) длиной 35 нуклеотидов, который демонстрирует те же связывающие свойства, что и его предшественник. Затем ученые применили ряд теоретических методов, включая моделирование сворачивания ДНК, квантово-химические расчеты и компьютерные симуляции. Эффективность аптамера была испытана в экспериментах на раковых клетках.
Сначала было проверено, способен ли усеченный аптамер связываться с раковыми клетками в организме пациента таким же образом, как и оригинальный LC-18. Эксперименты продемонстрировали, что LC-18t эффективно связывается с окрашенными опухолевыми клетками легких, но не связывается со здоровыми легкими и воспаленными тканями. Причиной этому стало усиление энергии связывания молекулы, а уменьшение длины сокращает количество форм, в которые может свернуться молекула, что облегчает процесс молекулярного узнавания мишени.
Будущее за моделированием
Исследователи также предложили новый протокол для моделирования структуры аптамера в будущем. Для этого нужно применить малоугловое рентгеновское рассеяние (SAXS), которое является мощным методом, позволяющим наблюдать за структурными переходами биологических молекул в растворах, подобных среде внутри живого организма. SAXS помогает определить форму аптамера в эксперименте. После этого нужно провести первоначальное молекулярное моделирование с использованием различных вычислительных методов, после чего данные из экспериментов и теоретических расчетов сравниваются друг с другом.
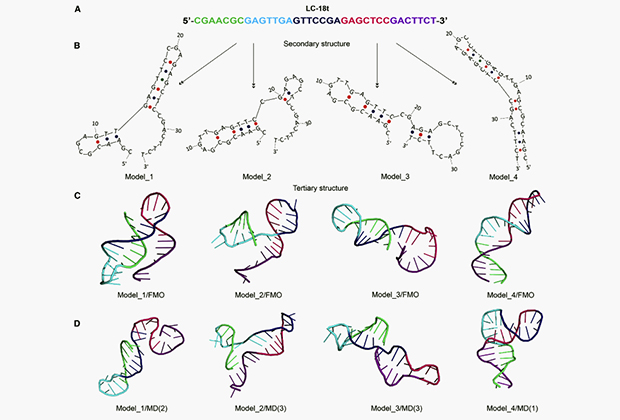
Разнообразные трехмерные структуры аптамера LC-18
Изображение: Elsevier Inc.
Предложенная процедура также может быть использована для анализа комплексов аптамер-мишень в будущем. Получив надежную атомистическую структуру в результате моделирования, можно рационализировать связывание аптамера с мишенью, например, белком. Это может быть очень полезно при разработке новых, более эффективных аптамеров на основе данных, полученных в результате молекулярного моделирования.
Аптамеры, обладающие высокой специфичностью к мишеням и чувствительностью, универсальными биофизическими и фармакокинетическими свойствами, заняли прочную нишу на рынке терапевтических препаратов и утвердились в качестве многообещающего нового класса лекарственных соединений. Можно ожидать, что благодаря эффективным методам моделирования такие соединения получат еще большее распространение и станут широко использоваться в борьбе с вирусными и бактериальными инфекциями, онкологическими заболеваниями, в диагностике генетических и других расстройств.